1����、超速離心法
此法分離和純化抗原的原理是利用各顆粒在梯度液中沉降速度的不同���,使具有不同沉降速度的顆粒處于不同密度梯度層內�,達到彼此分離的目的�����。常用的密度梯度介質有蔗糖����、甘油、CsCl等��。
用超速離心或梯度密度離心分離和純化抗原時����,除個別成分外,極難將某一抗原成分分離出來����,故只用于少數大分子抗原的分離,如IgM��、C1q��,甲狀腺球蛋白等,以及一些比重較輕的抗原物質如載脂蛋白A���、B等����。多數的中���、小分子量蛋白質采用此種方法很難純化�。
2���、選擇性沉淀法
其原理多根據各蛋白質理化特性的差異���,采用各種沉淀劑或改變某些條件促使蛋白質抗原成分沉淀,從而達到純化的目的��。常用的方法是鹽析沉淀法����。
鹽析法的原理
蛋白質在水溶液中的溶解度取決于蛋白質分子表面離子周圍的水分子數目�����,亦即主要是由蛋白質分子外周親水基團與水形成水化膜的程度以及蛋白質分子帶有電荷的情況決定的。蛋白質溶液中加入中性鹽后�,由于中性鹽與水分子的親和力大于蛋白質,致使蛋白質分子周圍的水化層減弱乃至消失����。同時���,中性鹽加入蛋白質溶液后由于離子強度發(fā)生改變�����,蛋白質表面的電荷大量被中和��,更加導致蛋白質溶解度降低�,使蛋白質分子之間聚集而沉淀�����。由于各種蛋白質在不同鹽濃度中的溶解度不同���,不同飽和度的鹽溶液沉淀的蛋白質不同��,從而使之從其他蛋白分離出來�����。常用的鹽溶液是33%~50%飽和度的硫酸銨���。鹽析法簡單方便��,可用于蛋白質抗原的粗提����,丙種球蛋白的提取����,蛋白質的濃縮等���。鹽析法提純的抗原純度不高�����,只適用抗原的初步純化�����。
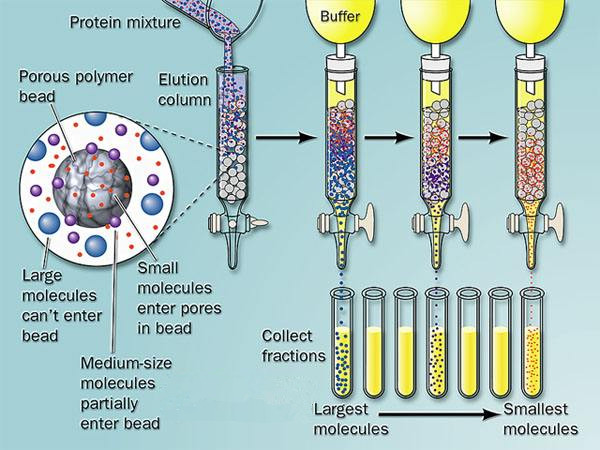
3���、凝膠層析法
凝膠層析是利用分子篩作用對蛋白質進行分離����。凝膠是具有三維空間多孔網狀結構的物質��,經過適當的溶液平衡后����,裝入層析柱�。一種含有各種分子的樣品溶液緩慢地流經凝膠層析柱時,大分子物質不易進入凝膠顆粒的微孔�����,只能分布于顆粒之間����,因此在洗脫時向下移動的速度較快,先被洗脫�。小分子物質除了可在凝膠顆粒間隙中擴散外,還可以進入凝膠顆粒的微孔中�����,洗脫時向下移動的速度較慢,隨后被洗脫���。因此,蛋白質分子按分子大小被分離�。
4、離子交換層析法
離子交換層析的原理是利用一些帶離子基團的纖維素或凝膠�,吸附交換帶相反電荷的蛋白質抗原。由于各種蛋白質的等電點不同�����,所帶的電荷量不同����,與纖維素(或凝膠)結合的能力有差別。當梯度洗脫時��,逐步增加流動相的離子強度���,使加入的離子與蛋白質競爭纖維素上的電荷位置���,從而使吸附的蛋白與離子交換劑解離。
在離子交換色譜技術中常用的離子交換劑有以下幾種
①具有離子交換基團的纖維素��,如羧甲基(CM)纖維素、DEAE-纖維素
②具有離子交換基團的交聯葡聚糖����、瓊脂糖和聚丙烯酰胺
③凝膠合成的高度交聯樹脂。
5�����、親和層析
親和層析是利用生物大分子的生物特異性����,即生物大分子間所具有專一親和力而設計的層析技術��。例如抗原和抗體����、酶和酶抑制劑(或配體)、酶蛋白和輔酶���、激素和受體�����、IgG和葡萄球菌蛋白A(SPA)等物質間具有一種特殊的親和力����。例如提純IgG時,可將SPA吸附在一個惰性的固相基質(如Speharose 2B�����、4B����、6B等)上,并制備成層析柱�。當樣品流經層析柱時,待分離的IgG可與SPA發(fā)生特異性結合����,其余成分不能與之結合。將層析柱充分洗脫后�,改變洗脫液的離子強度或pH值,IgG與固相基質上的SPA解離�����,收集洗脫液便可得到欲純化的IgG�。
上海恒遠溫馨提示: 親和層析法純化蛋白質抗原的主要優(yōu)點是純度高,簡單快捷,但成本較貴���。